

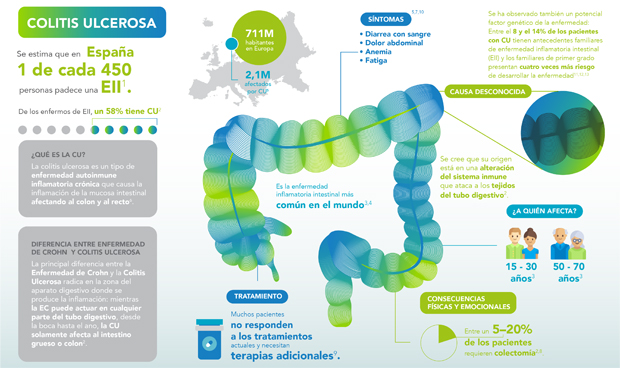
Pfizer ha anunciado que Xeljanz (tofacitinib) ya está disponible en España en las indicaciones de colitis ulcerosa (CU) activa de moderada a grave y artritis psoriásica activa (APs) en pacientes adultos1. De esta manera, Xeljanz se convierte en el primer y único inhibidor de las vías JAK a disposición de los profesionales sanitarios y pacientes españoles afectados por estas patologías, así como para el tratamiento de la artritis reumatoide.
“La opción terapéutica que representa tofacitinib, que ofrece una alternativa innovadora oral, abre nuevas esperanzas para mejorar la calidad de vida de los pacientes con estas patologías autoinmunes”, indica la doctora Susana Gómez, directora médica de la Unidad de Inflamación e Inmunología de Pfizer España. “Por ejemplo, a pesar de la existencia de otros tratamientos, muchos pacientes afectados por APs activa no responden a dichas terapias o los beneficios se ven reducidos a lo largo del tiempo. En el caso de la CU, el progreso en la investigación de nuevas opciones terapéuticas se hacía necesario y urgente, debido al impacto clínico y emocional que se observa en los pacientes con esta patología”, afirma la doctora Gómez.
Xeljanz está disponible en España en la indicación de artritis psoriásica activa, en un régimen de 5 mg dos veces al día, en combinación con metrotexato (MTX) para pacientes adultos que han tenido una respuesta inadecuada o que han sido intolerantes a un tratamiento previo con un fármaco antirreumático modificador de la enfermedad (FARME)1.
En el caso de la CU, tofacitinib está indicado para el tratamiento de pacientes adultos con colitis ulcerosa activa de moderada a grave que han tenido una respuesta insuficiente, una pérdida de respuesta o han sido intolerantes al tratamiento convencional o a un medicamento biológico. En esta patología, la dosis recomendada es de 10 mg dos veces al día para la inducción durante ocho semanas, seguido de 5 mg administrado dos veces al día como mantenimiento.
La inclusión en el Sistema Nacional de Salud de estas nuevas indicaciones de Xeljanz se formaliza en nuestro país después de que tofacitinib recibiera sendas aprobaciones por parte de la Comisión Europea: en junio de 2018 para APs y en julio de ese mismo año para su indicación en CU. Las aprobaciones europeas se basaron en los resultados obtenidos por el programa de estudios clínicos de fase 3 Oral Psoriasic Arthritis TriaLs (OPAL) , , respecto a la aprobación de su indicación de APs, y por los resultados de los estudios pivotales fase 3 del programa de desarrollo clínico global Oral Clinical Trials for tofAcitinib in ulceratiVE colitis (OCTAVE Induction 1, OCTAVE Induction 2, OCTAVE Sustain y el estudio de extensión OCTAVE Open, un estudio abierto a largo plazo que actualmente está en curso), para CU.
“La disponibilidad de Xeljanz en España para estas nuevas indicaciones demuestra que, para Pfizer, ofrecer tratamientos novedosos como tofacitinib a los pacientes es una prioridad y hace que nuestro trabajo cobre todo su sentido”, apunta la doctora Gómez.