La Comisión Europea ha aprobado Mylotarg® (gemtuzumab ozogamicin), de Pfizer, en combinación con daunorubicina (DNR) y citarabina (AraC), para el tratamiento de pacientes a partir de los 15 años de edad con leucemia mieloide aguda (LMA) CD-33 positiva de novo no tratada previamente, excepto la leucemia promielocítica aguda (LPA). Esta decisión convierte a Mylotarg en la única opción terapéutica aprobada para pacientes de LMA dirigida a CD33, un antígeno expresado en las células de más del 90% de los pacientes con LMA.
Infografía sobre la leucemia. |
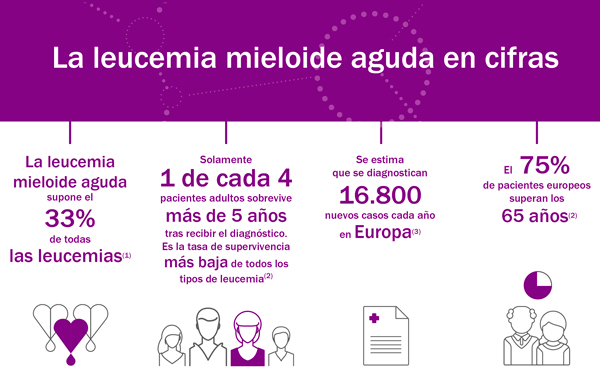
De esta manera, las casi 352.000 personas que actualmente viven con LMA en todo el mundo – el subtipo de leucemia más común en adultos presente en casi el 80% de los casos de leucemia aguda – y, en concreto, los 16.800 casos que se diagnostican cada año en Europa , ven aumentado el abanico de opciones terapéuticas para enfrentarse a la enfermedad. Esta aprobación supone que, a partir de ahora, la comunidad científica y médica cuentan con una nueva opción terapéutica para conseguir el principal objetivo del tratamiento: la remisión completa prolongada de la enfermedad, que está asociada con resultados óptimos y mayores beneficios para los pacientes.
"La LMA es un tipo de cáncer hematológico potencialmente mortal que progresa rápidamente. Si no se tratan, los pacientes con LMA podrían morir dentro de meses, sino semanas, a causa de la enfermedad, por lo que para la comunidad oncológica - pacientes, familias, especialistas e investigadores – es un avance enorme que Mylotarg® haya sido aprobado", afirma Cecilia Guzmán, directora médica de la Unidad de Oncología de Pfizer España. "Este gran avance es el resultado de una colaboración de muchos años entre Pfizer e investigadores en todo el mundo, y la prueba de que el trabajo de años de investigación y desarrollo de esta molécula llega por fin a los pacientes ayudando en la mejora de su pronóstico", añade Guzmán.
La decisión de la Comisión Europea se ha basado en la evaluación de los resultados del ensayo clínico de Fase 3 ALFA-0701, aleatorizado y abierto, en pacientes con LMA de novo no tratados previamente. Además, esta aprobación se une a la que recibió Mylotarg por parte de la Agencia Estadounidense del Medicamento (FDA, por sus siglas en inglés) en septiembre de 2017 para el tratamiento de adultos con LMA CD33-positiva de nuevo diagnóstico, así como para el tratamiento de adultos y niños mayores de 2 años con LMA CD33-positiva en recaída o refractaria.
Con esta nueva aprobación, Pfizer continua su trabajo de expansión del abanico de opciones terapéuticas para abordar los diferentes tipos de leucemia y en concreto la LMA. En el ámbito global, Pfizer cuenta actualmente con cuatro tratamientos para el tratamiento de la leucemia disponibles. A estos medicamentos se suman una gran variedad de moléculas que están en fases de desarrollo clínico y presentan el potencial para convertirse en futuros tratamientos para cánceres hematológicos.