|
Redacción. Madrid
HM Universitario Sanchinarro (HMS) realizó recientemente una resección hepática extendida, tras la realización de una bipartición del hígado in situ, a la que siguió la implantación de un sistema de soporte de hígado artificial. Un complejo abordaje que se llevó a cabo, “por primera vez en España”, y gracias a la “moderna e integrada forma de trabajar entre los servicios de Cirugía General y Digestiva, Anestesia, Cuidados Intensivos y Oncología del hospital, con la aplicación de las técnicas quirúrgicas, tratamientos médicos y soportes terapéuticos más avanzados que existen en la actualidad”.
Esquema de la intervención facilitado por HM Hospitales.
|
Así lo aseguraron el Dr. Emilio Vicente y la Dra. Yolanda Quijano, director y co-director, respectivamente, del Servicio de Cirugía General y Digestiva de HMS, durante la rueda de prensa celebrada el pasado 27 de septiembre en el citado centro para explicar los detalles, desarrollo y resultados de la intervención, desgranar las ventajas y objetivos de las diferentes etapas del procedimiento y analizar la importancia del abordaje individualizado de cada caso en los pacientes oncológicos.
Nueva estrategia en el tratamiento quirúrgico de las metástasis hepáticas
La resección hepática extendida tras la realización una bipartición del hígado in situ “representa una nueva estrategia para obtener una mayor radicalidad en el tratamiento quirúrgico de las metástasis hepáticas, aprovechando la experiencia acumulada del grupo quirúrgico de HMS en la cirugía del trasplante hepático de donante vivo”, señaló el Dr. Vicente.
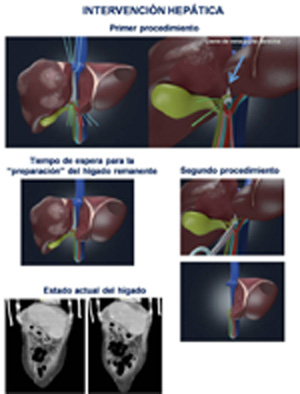
Para ello, se llevaron a cabo dos procedimientos quirúrgicos en diferentes tiempos, realizándose en el primero de ellos la bipartición completa hepática, en la que se dividió totalmente el hígado, dejando por un lado el lóbulo derecho junto con el segmento IV afecto de múltiples metástasis hepáticas con sus correspondientes pedículos vasculo-biliares, y por el otro lado los segmentos I, II y III hepáticos libres de enfermedad tumoral. “Esta zona del hígado, que igualmente mantuvo sus correspondientes pedículos vasculo-biliares -añadió el experto-, corresponde al hígado remanente que se va a mantener”. En el mismo acto quirúrgico se ligó la vena porta derecha en un intento de producir una hipertrofia compensadora del citado hígado remanente.
En el segundo procedimiento quirúrgico se seccionaron los pedículos vasculo-biliares previamente disecados y se efectuó la resección de la zona hepática afecta por la enfermedad metastásica. En el periodo de tiempo transcurrido entre los dos procedimientos que duró 20 días, se efectuaron dos estudios de volumetría hepática para conocer el incremento en el tamaño del hígado remanente. En este sentido, el Dr. Vicente indicó que el segundo procedimiento se efectuó una vez alcanzado el tamaño que se consideraba adecuado para la resección hepática (incremento de un 20 por ciento de su volumen con una relación del volumen del hígado con respecto al peso total de la paciente de un 0,8 por ciento).
Ventajas de la técnica
Para los expertos, las ventajas de esta técnica -realizada por los doctores Durán, Marcello, Díaz, Fabra y Puga, del mismo servicio que el Dr. Vicente y la Dra. Quijano; y los doctores Román, Corbacho, Carbajo, Álvarez y Rodríguez, del Servicio de Anestesia-, son evidentes: “Permite incrementar la radicalidad de la cirugía en este tipo de proceso mestastásico, rescatando a pacientes para la cirugía que de otra forma se podrían considerar irresecables; todo en un intento de de dejarles libre de enfermedad tumoral y en consecuencia de incrementar la supervivencia”, aseguraron.

Los doctores Córdoba, Quijano, Cubillo y Vicente explicaron la intervención realizada en HMS.
|
Asimismo, “la realización de este procedimiento en dos tiempos minimiza el riesgo quirúrgico con respecto a la técnica convencional. En el primero de ellos, que efectúa la partición del hígado pero sin resección, se facilita una mejor y más rápida evolución post-operatoria debido a que en esta fase no se efectúa resección de la zona afecta del hígado, sólo la disección y transección del parénquima. En el segundo procedimiento la técnica se simplifica gracias a que ya se ha efectuado toda la disección en el primero”, continuaron el Dr. Vicente y la Dra. Quijano.
Por último, la recuperación del paciente suele ser más rápida que con la técnica convencional y permite que éste pueda iniciar el tratamiento quimioterápico post-operatorio de una forma más precoz.
Implantación de un sistema de soporte de hígado artificial
Pero esta intervención tuvo otro elemento extraordinario adicional, ya que a pesar de la marcada hipertrofia compensadora que se había producido en el hígado remanente tras la embolización de la vena porta efectuada, en el post-operatorio apareció un cuadro de insuficiencia hepática moderada/severa, muy posiblemente facilitado por el daño del propio parénquima ocasionado por el prolongado tratamiento quimioterápico efectuado, que obligó a implantar en el paciente un sistema de soporte de hígado artificial.
Ante la presencia de este cuadro de insuficiencia hepática post-operatoria, que suele estar asociada a una elevada mortalidad, existen pocas opciones terapéuticas eficaces. No estando indicado el trasplante hepático por las características del proceso tumoral, se planteó la realización de un soporte hepático artificial, recordaron los responsables del Servicio de Cirugía General y Digestiva de HMS.
“Ante el fracaso hepático agudo el trasplante hepático es el único tratamiento definitivo y el único que mejora la supervivencia -la mortalidad, si no se realiza este procedimiento es muy elevada mortalidad, en torno al 80-85 por ciento”, señala por su parte el Dr. Ángel Luis Córdoba, coordinador del Servicio de Medicina Intensiva de HMS, apuntando no obstante que en el caso de la paciente intervenida “la naturaleza tumoral del cuadro descartaba la posibilidad del trasplante y el tamaño del remanente hepático presuponía capacidad potencial para suficiente función hepática en el futuro.
Se evaluaron por ello para esta intervención diversas técnicas de depuración, tales como la hemodiálisis, las técnicas continuas de reemplazo renal (TCRR), la plasmaféresis y, finalmente, el MARS (Molecular Adsorbent Recirculating System), un sistema de asistencia extracorpórea que sustituye la función de detoxificación del órgano hasta la recuperación de la función del hígado nativo o el trasplante.
Funcionamiento del MARS
El MARS “utiliza una diálisis de albúmina que elimina los metabolitos adheridos a la misma (liposolubles), ampliando el rango de depuración de las técnicas anteriores; acopla esta diálisis de albúmina con un tratamiento de hemodiafiltración y elimina así sustancias hidrosolubles y liposolubles; permite reutilizar la albúmina para uso continuo, lo que hace el sistema factible económicamente; es bien tolerado por el paciente; no requiere desplazamiento de éste; es sencillo para el personal familiarizado con TCRR y tiene una elevada seguridad y menos efectos secundarios”, detalló el intensivista.
El hígado artificial o diálisis hepática es un tratamiento de desintoxicación para las pacientes que sufren una grave alteración en el funcionamiento del hígado, completó por su parte el Dr. Vicente. Se trata de un abordaje parecido a la hemodiálisis y se basa en los mismos principios. Un punto crítico del síndrome clínico de insuficiencia hepática es la acumulación de toxinas que el hígado enfermo no puede limpiar.
Con base en esta hipótesis, el retiro de sustancias lipofílicas relacionadas con la albúmina, como la bilirrubina, ácidos biliares, metabolitos de aminoácidos aromáticos, ácidos grasos de cadena media y citocinas, es beneficioso para el curso clínico del paciente afecto de esta complicación. Esto se lleva a cabo mediante la utilización de sistemas de absorción y filtrado artificial, lo que produce una mejoría hemodinámica del paciente y un aumento del flujo sanguíneo hepático y renal, continuó el experto.
En concreto, añadió, el MARS consiste en dos circuitos de diálisis separados: el primero consiste en albúmina de suero humano, está en contacto con la sangre del paciente por medio de una membrana semipermeable y tiene dos filtros especiales para limpiar la albúmina después de que ha absorbió las toxinas de la sangre del paciente; el segundo es una máquina de hemodiálisis que se emplea para limpiar la albúmina del primer circuito antes de que vuelva a circular a la membrana semipermeable en contacto con la sangre del paciente.
Objetivo del procedimiento
“El sistema MARS puede retirar una buena parte de las toxinas, como amonio, ácidos biliares, bilirrubina, cobre, hierro y fenoles”, explicaron los doctores Vicente y Quijano, indicando que “el objetivo del soporte fue mantener la función hepática de forma temporal hasta conseguir una normalización de la misma a través del propio hígado de la enferma, situación que se produjo tres semanas después de la implantación del sistema”.
En este sentido, el D. Córdoba destacó entre los efectos clínicos que se consiguen con este sistema “una recuperación de la función renal y una mejora hemodinámica, una reducción de la presión intracraneal y de los niveles de metabolitos tóxicos, una corrección de la encefalopatía y una mejora de los marcadores de síntesis hepática y de la supervivencia en ciertas etiologías”.
El sistema de soporte de hígado artificial se utiliza especialmente en pacientes con insuficiencia hepática aguda o crónica agudizada como puente a la realización de un trasplante ortotópico hepático. En España se implanta anualmente en unos 250 pacientes, todos ellos en hospitales públicos. Sin embargo, “la utilización para situaciones de insuficiencia post-operatoria tras resección hepática es inferior al 10 por ciento de la casuística previamente citada, por lo que este caso, realizado, además del Dr. Córdoba, por los doctores Martínez, Morato y Grando, también de la Unidad de Cuidados Intensivos de HMS, representa la primera utilización de este sistema en un hospital privado”, afirma el Dr. Vicente.
Tratamiento oncológico individualizado
“Aproximadamente un 50-60 por ciento de los pacientes afectos de metástasis hepáticas de cáncer colorrectal tienen respuesta clínica, radiológica y metabólica parcial tras efectuar un tratamiento quimioterápico, sólo un 20 por ciento de ellos tienen respuesta completa en los aspectos citados”, dicen los expertos, precisando que “un número importante de estos pacientes no se intervienen quirúrgicamente y, en consecuencia, es imposible conocer si existe una respuesta patológica completa, que aparece sólo en un 4 por ciento de los pacientes, y fundamentalmente en enfermos con pocas lesiones y de pequeño tamaño”.
En el caso concreto de la paciente intervenida, a su enfermedad metastásica bilobar masiva -con un volumen de enfermedad tumoral hepática superior al 40 por ciento- se le aplicó un tratamiento quimioterápico individualizado, adaptado a las características moleculares del tumor.
La excelente coordinación de todos los grupos de profesionales que forman parten de la Unidad de Tumores Digestivos del Centro Integral Oncológico Clara Campal (CIOCC) es lo que permite alcanzar con el éxito e intervenciones de esta magnitud y complejidad”, afirmó por su parte el coordinador de esta unidad, el Dr. Antonio Cubillo.
“El equipo de Oncología dirigido, por el Dr. Manuel Hidalgo, y la Unidad de Tumores Digestivos -continuó- pone a disposición de cada uno de los pacientes del centro las últimas tecnologías existentes en análisis molecular de la biología tumoral, lo que, añadido a una filosofía de tratamiento basada en cada caso de forma individual, permite desarrollar una actividad clínica al máximo nivel según las necesidades de la situación particular de cada paciente”.
Una vez concluido el tratamiento quimioterápico, efectuado por los citados doctores Hidalgo y Cubillo, además de los doctores Rodríguez y Álvarez, del Servicio de Oncología del CIOCC, anexo a HMS, y tras ser intervenida quirúrgicamente, se pudo comprobar en el hígado resecado (70 por ciento del volumen total) la ausencia de enfermedad; es decir, la existencia de una respuesta patológica completa, circunstancia excepcional, dada la magnitud de tejido tumoral existente, y que “es manifestación clara de que en la actualidad el uso de fármacos oncológicos en el tratamiento del cáncer debe de ir dirigido a diferentes biomarcadores, evitando la uniformidad en los regímenes terapéuticos que no siempre son eficaces”, concluyó el Dr. Vicente.
|